Introduction
Les ressources biologiques ont de tout temps été exploitées
par l’Homme pour différents usages. Dans le domaine thérapeutique, les vertus
curatives ou au contraire la toxicité des plantes ont été très tôt
utilisées. Aujourd'hui, à côté des médicaments fabriqués uniquement par
synthèse chimique, d'autres sont obtenus par traitement chimique de substances
naturelles, végétale le plus souvent, animales ou micro-organismes. Il existe
également des remèdes purement naturels qui sont rarement d'origine animale
(comme le miel) ou minérales (comme la tourbe médicinale) mais qui proviennent
presque exclusivement de plantes.
Les molécules issues de ces organismes peuvent être
utilisées comme réactifs dans un but de diagnostique ou de thérapie. Dans un
premier temps, ces molécules étaient extraites d’organismes vivants, c'était le
cas notamment de l'insuline à partir des pancréas de porc. Ces systèmes ne
permettent pas une production suffisante en terme de quantité ce qui implique
un coût élevé d’extraction d’autant plus que les risques sanitaires ne sont pas
négligeables. Pour pallier à ces inconvénients, le génie génétique a permis la
production de ces molécules thérapeutiques dans des organismes hétérologues.
C’est ainsi que des fermenteurs microbiens ou des cultures
de lignée cellulaire de mammifère ont été utilisés pour mieux contrôler la
production. Cependant ces systèmes ont des désavantages en termes de coûts et
de sécurité, ce qui a conduit la recherche vers d’autres alternatives. Dans le
but d’éliminer les risques de contamination par des endotoxines ou de
pathogènes, des vaccins candidats ont pu être exprimés dans des organites de
plantes transgéniques. Le génie génétique permet, en principe, de faire
synthétiser n'importe quelle protéine à partir d'un gène isolé et transféré
dans une cellule qui prend en charge son décodage et le plus souvent la
sécrétion de la protéine en question. Une protéine ainsi obtenue en dehors de
sa cellule d'origine est dite recombinante.
Depuis le développement du génie génétique l’utilisation des
plantes à radicalement changé, elle est passée du statut de matière première à
celui de plates-formes de production. L’utilisation des plantes transgéniques à
des fins thérapeutiques peuvent elles être considérées comme un outil pour la
valorisation des ressources génétiques ? Quels sont les impacts sur les
détenteurs des ressources génétiques ?
Afin de répondre à cette problématique, nous traiterons dans une première partie des plantes transgéniques en tant que plates-formes de production pour les biopharmaceutiques, en étayant par des exemples concrets et une comparaison avec les autres modes de production. Dans une seconde partie, nous traiterons la question des détenteurs des ressources génétiques avec les problèmes liés à l’appropriation du vivant et la situation actuelle des détenteurs des ressources génétiques.
I.
Les plantes transgéniques : des
plates-formes de production pour biopharmaceutiques
Les produits biopharmaceutiques sont élaborés à partir de
macromolécules complexes créées par la manipulation génétique d’organismes
vivants en utilisant des technologies telles que le clonage de gènes, l'ADN
recombinant, ou des technologies de fusion de cellules.
Dans le cas des plantes, plusieurs techniques de transgénèse
ont été développées. Les plantes transgéniques peuvent être ainsi utilisé comme
des plates-formes de production de molécules thérapeutiques soit par voie
direct dans le cadre de la production d’anticorps ou de lipase gastrique soit
par voie indirect dans le cadre de la synthèse de terpène. Il conviendra
d’analyser également l’émergence de l’utilisation des plantes transgéniques
comme plates-formes de production pour biopharmaceutiques en la comparant avec
les autres organismes génétiquement modifiables.
A. Les techniques de transgénèse
Après avoir illustrer le principe de la transgénèse, les
avantages et les inconvénients de ces techniques seront traités.
1.
Historique :
La "galle du
collet" (ou crown gall) est une maladie qui atteint de nombreuses plantes
cultivées suite à des lésions. Le grossissement démesuré de la tige des espèces
végétales atteintes est l'un des symptômes caractéristiques facilement
observable. En l'état, ceci se traduit par le dépérissement de la plante. [10]
Au début du siècle, le phytopathologiste américain, Erwin
Smith identifia l'agent de cette maladie : une bactérie du sol, Agrobacterium tumefaciens. Cette
bactérie affecte naturellement les dicotylédones.[38] Entre 1960 et 1970, Georges Morel et ses
collaborateurs de l'INRA de Versailles, ont montré que la tumeur induite par
ces bactéries sur les plantes sensibles fait que celles-ci synthétisent des
substances particulières, les opines. Ces substances spécifiques, absentes des
cellules végétales saines, sont synthétisées par les cellules tumorales. Cette
découverte conforta l'idée que l'acquisition de la propriété de synthétiser des
opines par les cellules tumorales résultait d'un transfert d'information
génétique de la bactérie à la cellule végétale. [16]
Cette hypothèse, qui fut validée en 1974 grâce aux travaux
de l'équipe de Jeff Schell et Marc Van Montegu en Belgique, montra que cette
transformation génétique des cellules végétales était l'oeuvre de plasmides
présents dans les souches virulentes de Agrobacterium.
Dans le cas de la galle du collet ce plasmide est appelé Ti (pour Tumor
inducing).[16]
Enfin, en 1977, Mary Dell Chilton en association avec une
équipe américaine, montrait que la transformation de cellules végétales par Agrobacterium tumefaciens résulte de
l'intégration dans leur génome d'un fragment d'ADN (appelé ADN-T pour ADN
transféré) issu des plasmides Ti. Les gènes portés par l'ADN-T ne s'expriment
pas dans Agrobacterium, mais
seulement dans le noyau des cellules végétales ; présents sur le plasmide Ti,
ils apportent des signaux de régulation de type eucaryote. .[38]
2.
Définition :
La transgénèse - ou transfert de gènes - est
l'addition d'un gène étranger, appelé transgène, mais aussi dans d'autres cas
le remplacement d'un gène par recombinaison homologue et de le faire
fonctionner dans un être vivant. L'organisme ou la cellule, qui reçoit alors
l'ADN étranger, est susceptible de réagir en fonction de l'information
génétique qui lui est transmise, par exemple en fabriquant une protéine non
synthétisée naturellement. [16]
3.
Les techniques de transfert de gènes chez
les végétaux
Les plantes peuvent être régénérées assez facilement à
partir d'une cellule somatique. Cette capacité découle de la propriété de
totipotence des cellules végétales lui conférant in vitro la faculté de régénérer une plante entière. La cellule
végétale est donc apparue comme l'unité fondamentale dans le processus de la
création d'une lignée de végétaux transgéniques. En revanche, la paroi
pectocellulosique cellulaire rigide (absente chez les cellules animales) constitue
un obstacle au transfert de gène, qui peut être contourné par l'utilisation des
bactéries du genre Agrobacterium. [16]
L'existence d'espèces végétales insensibles à cette bactérie
a incité les chercheurs à mettre au point d'autres méthodes. Aussi,
actuellement deux familles de techniques sont réalisées pour la transformation
génétique de cellules végétales : l'une consistant à utiliser les
propriétés de Agrobacterium,
l'autre faisant intervenir des méthodes physiques ou chimiques qui permettent
la pénétration
de l'ADN directement dans les cellules végétales. [19]
a)
La transformation de cellules végétales
par Agrobacterium :
L’exemple de la transformation d’un plant de tabac par un
gène résistant à la kanamycine est une bonne illustration pour expliquer les
différentes étapes de la transgènese par Agrobacterium.
Le principe de la transgènese repose sur les caractéristiques du plasmide Ti
natif (Figure 1) portée par Agrobacterium
tumefaciens qui est alors utilisé comme un vecteur. Le plasmide natif est
responsable de la tumorisation des cellules végétales mais grâce à une
modification génique, il peut être utilisé la transgènese. Les gènes ONC
(Auxine, Cytokinine et Opine) possèdent des fonctions oncogènes pour les
cellules végétales. Ils sont supprimés de l’ADN-T et sont remplacés par le gène
d’intérêt. Ceci a pour effet de désarmer le plasmide tout en conservant la
possibilité de transférer le gène de la bactérie vers le noyau de la cellule
végétale par l’intermédiaire du gène VIR. [38]
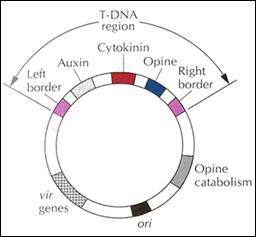
Figure 1: Carte simplifié du plasmide Ti natif
De manière simplifiée, quatre étapes peuvent être décrite
pour obtenir des plants de tabac transformés. [16] Dans un premier temps,
la construction génique réalisé en laboratoire associe trois parties :
Ø
la séquence codante du gène
d’intérêt. Le gène d'intérêt, identifié et isolé, est ici une séquence codante
conférant la résistance à la kanamycine (néomycine phosphotransférase NPT);
Ø
un promoteur NOS (nopaline
synthétase) de l'ADN-T d'Agrobacterium ;
Ø
un terminateur NOS de ce même
ADN-T.
Les deux dernières parties constituent des parties du
plasmide Ti de la bactérie et sont nécessaires pour pouvoir faire fonctionner
le gène associé dans un environnement nouveau, la cellule végétale.
Dans un deuxième temps, la bactérie transformée est incubée
avec des fragments découpés de feuille de tabac. Les cellules végétales sont
blessées, le système naturel de transfert de gènes d'Agrobacterium est alors stimulé les cellules végétales blessées
permettent de stimuler le transfert de gène par Agrobacterium. Les fragments de feuilles sont ensuite incubés en
présence de kanamycine et seules les cellules transformées proliféreront et
formeront des cals.
Dans une troisième étape, ces cals sont mises en cultures
sur des milieux appropriés contenant des phytohormones. Certaines des cellules
donneront des bourgeons, qui s'enracineront ensuite pour régénérer des plantes
entières.
Pour finir, afin de vérifier que les plantes régénérées sont
bien transformées, leurs graines obtenues par autofécondation sont semées sur
un milieu contenant de la kanamycine. Statistiquement, 1/4 des plantes ne
possèdent pas le gène de résistance : c'est la proportion attendue pour un
gène quelconque. [16] Plusieurs possibilités se présentent :
Ø
Soit des plantes dépourvues de
chloroplastes car la kanamycine interfère avec leurs développements. Ces
plantes sensibles sont blanches et leur développement est alors arrêté.
Ø
Soit des plantes chlorophylliennes
normales et dans ce cas, ces dernières sont résistantes à l'antibiotique, et
assure la mise en place de chloroplastes fonctionnels nécessaires à la
poursuite du développement.
Ø
Ce gène introduit se conduit comme
n'importe quel autre gène : il fait alors partie du patrimoine génétique de la
plante qualifié alors de transgénique. Cependant pour être qualifiée de
transgénique il faut que toutes les cellules de la plante possèdent le
transgène sinon, il s'agit d'une plante chimère. Des analyses moléculaires au
niveau de l'ADN sont aussi pratiquées pour vérifier le transfert du gène
(Southern blot, Northern blot, PCR). [16]
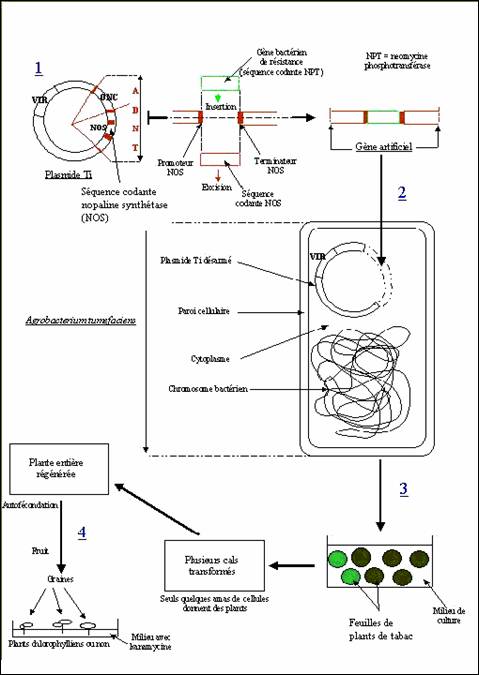
Figure 2 : Transfert du gènes
de résistance à la kanamycine dans une cellule de plant de tabac. [18]
(1) Réalisation d'une construction génique ou gène
artificiel. (2) Recombinaison puis insertion du fragment d'ADN dans le plasmide
Ti désarmé (privé de la séquence ONC, fonction oncogène) puis introduction du
plasmide Ti modifié dans la bactérie hôte. (3) Transfection du plasmide modifié
dans des feuilles, par Agrobacterium (4) Contrôle de l'efficacité du transfert
et sélection des organes exprimant le gène transféré.
b)
Le transfert direct de gènes :
Il existe des techniques de transfert direct d'ADN, par des
méthodes chimiques, physiques ou faisant appel à des impulsions électriques.
Une fois éprouvées sur des cellules animales, ces méthodes ont été testées sur
des protoplastes.
Transformation de
protoplastes : [16]
Ø
par méthode chimique, en utilisant
le polyéthyléneglycol (PEG), une molécule capable d'induire la déstabilisation
de la membrane plasmique et qui permet le transfert d'ADN à travers celle-ci ;
Ø
par méthode physique, en réalisant
la fusion entre les protoplastes et des liposomes (vésicules artificielles de
phospholipides encapsulant l'ADN à transférer) ;
Ø
par méthode faisant appel à des
impulsions électriques, elle consiste à soumettre un mélange de protoplastes et
d'ADN à une série de chocs électriques de courte durée et de tension élevée. Le
champ électrique provoque la déstabilisation de la membrane plasmique par
polarisation des phospholipides qui la constituent et induit alors la formation
de pores à travers desquels les molécules d'ADN peuvent transiter.
Transformation directe de cellules, de tissus, ou d'organes
:
Cette méthode permet dans ces différents cas de palier aux
limites de la transformation de protoplastes pour les espèces dont la
régénération des plantes en culture in vitro n’est pas maîtrisé. La pénétration
de l'ADN peut être forcées à travers la paroi pectocellulosique des cellules
végétales, par l’intermédiaire d’un canon à particules (Voir figure 3). Le principe
consiste à projeter sur le tissu à transformer de toute petites billes d'or ou
de tungstène enrobés d'ADN. Ces billes projetées ont suffisamment d'énergie
cinétique pour traverser la paroi et la membrane des cellules sans leur
infliger de dommages irréparables. L'ADN est ainsi introduit dans des tissus
comme des embryons ou des méristèmes qui vont directement générer une plante. [19]
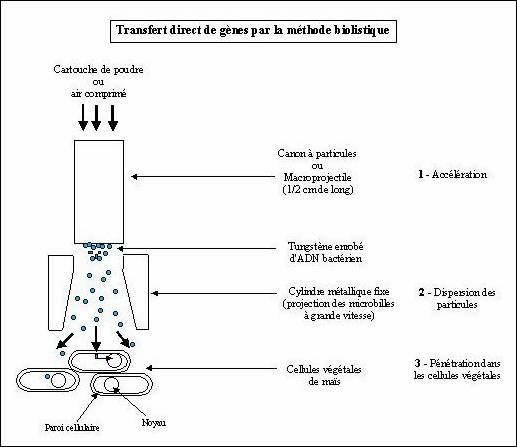
Figure 3 : L'exemple du transfert d'un gène
bactérien dans du maïs par la méthode du canon à ADN[19]
4.
Avantages et inconvénients des
différentes techniques de transfert de gènes
Le succès de la transgénèse végétale repose sur la
conjonction de plusieurs conditions qui doivent être réunies simultanément :
Ø
pénétration de l'ADN étranger
jusque dans les noyaux des cellules végétales ;
Ø
intégration dans le génome de
l'hôte, c'est à dire dans un des chromosomes afin que le transgène puisse se
répliquer et devenir stable au sein du génome nucléaire et ainsi être transmis
aux cellules filles ;
Ø
aptitude des transgènes à être
exprimés, suite à la transcription en ARN dans le noyau et à la traduction en protéine
dans le cytoplasme ;
Ø
sélection et régénération de
plantes entières à partir des cellules génétiquement modifiées. La sélection
s'effectue grâce à un gène marqueur conférant la résistance à un antibiotique
toxique (ou à un herbicide) pour la cellule végétale transformée.
Comme la majorité des productions de protéines recombinantes
est basée sur l’intégration du transgène dans le génome nucléaire ce qui
demande une étape relativement longue
dans la production de plantes transgéniques, d’autres systèmes alternatifs ont
été étudiés pour facilité les étapes de production. En effet, plusieurs études
ont montré que l’infiltration d’un transgène par la technique classique Agrobacterium tumefaciens possède une
autre limite importante, celle d’une chute tendancielle du taux de protéines
recombinantes au bout de quelques jours. Ceci serait en partie du à un gène
d’extinction (« silencing »). Ainsi pour le tabac, une technique
alternative basée sur des vecteurs d’expression contenus sur des virus de
plante connu est utilisée pour la transgenèse. L’avantage de la production
basée sur les virus est d’une part l’expression rapide du transgène due à la
dispersion systémique du virus qui permet la production dans chaque cellule et
d’autre part l’utilisation de plusieurs vecteurs d’expression autorisant la
fabrication de protéines multimériques. [16]
Les techniques de transfert par protoplastes présentent
quelques limites. En effet, les techniques appliquées aux protoplastes végétaux
sont actuellement applicables uniquement chez les espèces dont la mise en
culture est maîtrisée et la régénération des plantes à partir des protoplastes.
Néanmoins ces techniques de transformation par protoplastes sont intéressantes
pour les plantes insensibles à l’Agrobacterium.
C’est le cas des céréales monocotylédones de grande culture, telles que le riz,
le maïs ou l'orge qui ont été transformées pour la première fois par ces
méthodes. D’autres techniques de transfert direct sont aussi en cours d'étude
comme la transformation du pollen, la sonication de tissus, la micro injection
d'ADN dans les tissus conducteurs ou encore l'imbibition d'embryons et même des
systèmes de fibres carbones où l'ADN est adsorbé. [19]
La transgenèse du chloroplaste est une autre variante
prometteuse. L’avantage principal de cette technique est l’absence de gène
d’extinction. De plus les gènes peuvent être exprimés en opéron et s’accumuler
dans le chloroplaste limitant la toxicité pour la plante hôte. Le transgène
intégré dans le génome chloroplastique n’est pas transmis par le pollen. La
transformation chloroplastique a été utilisée pour la fabrication de fragment
de toxine tétanique et de sérum albumine. Par ailleurs la transformation de
chromoplaste chez la carotte et la tomate offre des perspectives intéressantes
pour la production de sous unités de vaccin. [40]
A l'heure actuelle, la plupart des plantes de grande culture
(soja, maïs, blé, riz, coton tournesol, pomme de terre, colza, tomate) sont
accessibles à la transformation génétique. [19]
B.
L’émergence de plates-formes de
production pour les biopharmaceutiques
Pour comprendre l’émergence de ces nouvelles plates formes
de production, il convient de mettre en relief la potentialité des espèces
végétales. Cette capacité de production sera illustré à travers trois exemples
concrets : la production d’anticorps, de lipase gastrique et de terpène
aux propriétés médicinales.
1.
Potentialité des espèces végétales
L’espèce hôte a été le facteur limitant lors de l’émergence
de ces nouvelles plates-formes de production. Les premières protéines
recombinantes furent produites à partir de plante de tabac transgénique où les
molécules ont été extraites directement à partir des feuilles. Le tabac est une
plante où le système d’expression est bien caractérisé. Ceci permet d’effectuer
une mise au point optimale pour obtenir un rendement de production important.
De plus le tabac est une plante inscrite dans aucun processus alimentaire
humain ou animal ce qui exclu une quelconque contamination. Le désavantage
principale du tabac est la présence élevé de nicotine ou autres toxiques
alcaloïdes qui nécessite une étape supplémentaire d’extraction. Les autres
plantes feuillues peuvent offrir de bonnes alternatives comme la laitue ou la
luzerne. [9][4]
Les avantages de la luzerne sont d’une part un rendement
important et d’autre la fixation de ses composées nitrogènes ainsi qu’une
structure des glycanes homogènes. Cependant la luzerne, utilisé pour alimenter
le bétail, est une source importante d’acide oxalique qui peut interféré sur le
processus de production des plantes transgéniques. [11]
Bien que les feuillus ont un avantage certain dans le
rendement, les protéines ainsi produites tendent à être instable contrairement
aux céréales comme le maïs où les protéines produites sont protégées des
dégradations protéolytiques. Le maïs est choisis en particulier pour sont
rendement important mais surtout pour sa transformation et sa manipulation facilitées
in vitro. Le maïs est utilisé pour la production d’enzymes utiles pour les
techniques de biologie moléculaire comme la beta-glucuronidase, de sous unités
de vaccins et d’anticorps.[34][9]
Ces avancés technologiques dans l’émergence de nouvelles
plateformes de productions de biopharmaceutiques peuvent constitué un réel
avantages lors de large campagne de vaccination. Ainsi la pomme de terre a été
le premier système utilisé pour la production de vaccins testés dans plusieurs
études cliniques. La pomme de terre a été étudiée pour la production de
TNF-alfa, de sérum albumine et d’anticorps. D’autres hôtes sont étudiés pour la
production de vaccins comme les tomates, les bananes, les carottes, et Arabidopsis. [10]
La production de protéines recombinantes peut être facilités
par l’intermédiaire de plantes transgénique huileuse où les systèmes
d’extraction et de purification sont plus efficaces. A terme, ceci permettrait
l’élaboration d’un bio réacteur en production continu de molécules
thérapeutiques.[28]
De nombreuses plantes transgéniques produisant des molécules
pharmaceutiques sont en développement ou sur le point d'être commercialisées.
Le tableau 1 montre des exemples de molécules d'intérêt thérapeutique produites
à partir de plantes transgéniques.
Tableau 1 : Exemples de
molécules d’intérêt thérapeutiques produites à partir de plantes transgéniques[9]
|
Catégorie |
Protéine |
Application et
spécificité |
Plante |
|
Protéines sanguines |
Albumine |
Contrôle du volume sanguin, |
pomme de terre, |
|
et plasmatiques |
|
excipient |
tabac |
|
|
Aprotinine |
Anti-fibrinolytique |
maïs |
|
|
Collagène I homotrimérique |
Agent homéostatique, scellant
tissulaire |
tabac |
|
|
Enképhalines |
Analgésique |
tabac |
|
|
Hémoglobine |
Substitut sanguin |
tabac |
|
Vaccins |
Bet v 1 |
Traitement des allergies de
type |
tabac |
|
|
Sous-unité de toxine B du
choléra |
Traitement du choléra |
pomme de terre |
|
|
Glycoprotéine B du CMV |
Traitement d’une infection |
tabac |
|
|
|
par le cytomégalovirus |
|
|
|
Sous-unité de toxine B |
Traitement du diabète |
pomme de terre |
|
|
du choléra fusionnée avec
insuline |
auto-immun |
|
|
|
Peptide D2 de la protéine B |
Vaccin mucosal ne requérant |
haricot noir |
|
|
liant la fibronectine de S.
aureus |
pas d’adjuvant |
|
|
|
VP1 |
Traitement de la fièvre
aphteuse |
luzerne, haricot noir |
|
|
Hémagglutinine |
Traitement de la grippe |
tabac |
|
|
Antigène de l’hépatite |
Traitement de l’hépatite B |
Tabac, pomme de terre |
|
|
Entérotoxine B de E. coli |
Traitement des diarrhées |
pomme de terre, tabac |
|
|
Épitope de P. falciparum |
Traitement du paludisme |
tabac |
|
|
Protéine de capside |
Traitement des diarrhées |
tabac, |
|
|
du virus de Norwalk |
causées par le virus de
Norwalk |
pomme de terre |
|
|
Protéine G du virus de la
rage |
Vaccination contre la rage |
tabac, épinard, tomate |
|
|
Auto-antigène |
Traitement du diabète
auto-immun |
pomme de terre |
|
Anticorps |
IgG C5-1 |
Anti-IgG diagnostique |
luzerne |
|
|
IgA contre S. mutans |
Prévention de carie dentaire |
tabac |
|
|
IgG contre la créatine kinase |
Anticorps diagnostique |
tabac |
|
|
IgG contre l’antigène |
Traitement du cancer du côlon |
tabac |
|
|
tumoral CO17-1A |
|
|
|
|
ScFv contre antigène |
Traitement des cancers |
céréales |
|
|
carcino-embryonnaire (CEA) |
|
|
|
Hormones, cytokines |
GM-CSF |
Facteur de croissance |
tabac |
|
et facteurs |
|
hématopoïétique utilisé |
|
|
de croissance |
|
dans le traitement de
neutropénie |
|
|
|
Interféron |
Traitement d’hépatites B et C |
tabac |
|
|
Interféron |
Traitement d’hépatites B et C |
tabac |
|
|
Somatotropine (hGH) |
Traitement des désordres de
croissance |
tabac (chloroplastes) |
|
|
Érythropoïétine |
Traitement de l’anémie |
tabac (cellules) |
|
|
Epidermal growth factor (EGF) |
Contrôle de prolifération
cellulaire |
tabac |
|
Enzymes |
Enzyme de conversion |
Hypertension |
tabac et tomate |
|
|
de l’angiotensine |
|
|
|
|
Protéine c (protéase sérique) |
Anti-coagulant |
tabac |
|
|
Glucocérébrosidase |
Maladie de Gaucher |
tabac |
|
|
-trichosantine |
Inhibe la réplication du VIH |
tabac |
|
Autres |
Hirudine |
Anti-coagulant |
tabac, colza |
|
|
Lactoferrine humaine |
Anti-microbien |
tabac |
Faye L., Landry N., La
production de protéines à usage biopharmaceutique dans les plantes,
médecine/sciences (2001) ; 17 : 867-77
2.
Production d’anticorps dans les plantes
transgéniques
a) Exemples d’anticorps produits
Plus d’une centaine d’études cliniques utilisant des
anticorps sont actuellement en cours dans le traitement de diverses maladies
comme les dysfonctionnements du système immunitaire, les maladies
inflammatoires, certains cancers, des désordres du système nerveux central et
des maladies infectieuses. La plupart des applications proposées nécessitent
l’utilisation d’anticorps complets.[4]
Exception faite des hybridomes, seules les cellules de
mammifères, les animaux transgéniques ou les plantes transgéniques sont
capables d’associer les chaînes lourdes et légères constitutives de l’anticorps
par des ponts disulfure. La culture de cellules mammifères est un procédé
coûteux ayant une capacité limitée. [4][34]
La machinerie de biosynthèse et de maturation des protéines
présente suffisamment d’homologies dans une cellule animale et dans une cellule
végétale pour que de très nombreuses protéines à usage pharmaceutique d’origine
mammifère aient été déjà produites avec succès dans des plantes transgéniques.
La production de différents types d’anticorps recombinants tels que des IgG ou
des IgA sécrétoires font partis des succès majeurs dans ce domaine.
Cependant, sous leur forme actuelle, les plantes ne sont pas
encore idéales pour la production de ces protéines parce qu’elles produisent
des molécules dont la glycosylation n’est pas toujours compatible avec une
application thérapeutique chez l’homme.[34]
b) Problème du a la glycosylation
La N-glycosylation des protéines est très spécifique selon
le système d’expression. La structure du complexe N-glycan-proteine diffère
selon si l’organisme est une plante, un insecte, un micro-organisme ou un
mammifère. Ceci est un problème important en particulier pour la production
d’immunoglobuline. En effet, les propriétés des immunoglobulines dépendent de
leur glycosylation. En 1997, il a été montré que des IgG non glycosylisées
perdaient leur capacité à se fixer sur les récepteurs des monocytes. Le
processus de liaison des structures N-glycanes s’effectue au cours de la voie
de sécrétion lorsque la glycoprotéine transite du réticulum endoplasmique à
travers l’appareil de Golgi jusqu'à sa destination finale. Il a donc été
important d’étudier comment le processus de glycosylation et les structures de
glycane sur les protéines de cellules de mammifères produites dans des plantes
transgéniques différaient de leurs homologues originels.[9][34]
Ces différences ont pu être mis en évidence par la
comparaison de la N- glycosylation d’anticorps murins et de leur homologue chez
la plante de tabac. Par exemple, l'anticorps monoclonal Guy's 13 qui est
spécifique d'une adhésine de Streptococcus
mutans, une bactérie responsable de la carie dentaire [N-glycosylation of a
mouse IgG intransgenic tabacco plants] (voir figure 4). Quand elle est produite
dans des hybridomes murins, cette IgG1 est glycosylée sur deux sites de N-glycosylation
par des structures oligosaccharidiques (N-glycanes) qui présentent un résidu
(1,6)-fucose et environ 10% d'acide sialique terminal. Lorsqu'il est produit
sous forme recombinante dans des plantes de tabac, l'anticorps Guy's 13 est
également glycosylé sur les mêmes sites de N-glycosylation. [34][4][9]
En revanche, les N-glycanes de cet anticorps sont de type
oligo-mannosidique, des structures communes aux plantes et aux mammifères, mais
aussi de type complexe et, dans ce dernier cas, leur structure est typique des
végétaux. Ainsi, les N-glycannes complexes associés à l'anticorps Guy's 13
produit dans le tabac présentent des caractéristiques structurales, telles que
la présence de (1-2)-xylose et (1,3)-fucose, qui leur confèrent une forte
immunogénicité chez certains mammifères, et en particulier chez l’homme.[9]
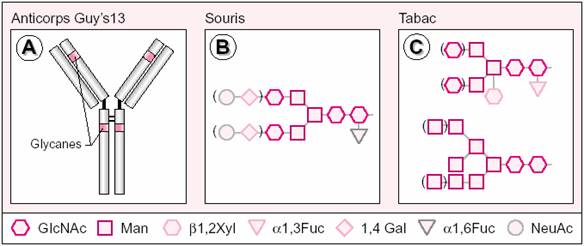
Figure
4 : Glycosylation de l'anticorps Guy's 13.
[9]
L’anticorps
monoclonal Guy’s 13 est une IgG1 présentant deux sites de N-glycosylation,
représentés en rouge sur la chaîne lourde (A). Cet anticorps spécifique d’une
adhésine de Streptococcus mutans a été produit sous une forme biologiquement active utilisable
pour lutter contre la carie dentaire, dans des hybridomes (B) et dans des
plantes de tabac (C). Les structures des N-glycanes de l’anticorps murin (B) et
du planticorps (C) illustrent les différences majeures observées dans la
glycosylation de cet anticorps lorsqu’il est produit dans l’un ou l’autre
système. [Faye et al. La production de protéines à usage biopharmaceutique dans
les plantes. médecine/sciences 2001 ; 17 : 867-77]
3.
La production de lipase gastrique dans le
tabac
a) Intérêt de produire de la lipase gastrique
Les lipides, principalement les triglycérides à chaînes
longues, constituent le principal apport calorique de l’alimentation humaine.
La digestion de ces lipides dans le tube digestif (ou lipolyse) est assurée par
deux enzymes naturellement produites au moment du repas, la lipase gastrique et
la lipase pancréatique. Ces enzymes sont indispensables à la libération des
acides gras et à leur assimilation au niveau de l’intestin grêle. Certaines
affections de l’estomac et du pancréas peuvent être responsables d’une
réduction, voire d’une absence, de sécrétion de ces enzymes digestives et être
à l’origine de troubles nutritionnels sévères. C’est le cas notamment chez les
personnes atteintes de mucoviscidose et de pancréatite chronique. L’apport
d’enzymes exogènes sous forme d’extraits pancréatiques d’origine animale
représente actuellement le seul traitement possible de ces maladies.[24][25]
La mucoviscidose est la maladie génétique la plus fréquente
dans les pays occidentaux avec une fréquence à la naissance de 1/2500. Le
nombre de personnes atteintes de cette maladie dans le monde est estimé à prés
de 70 000 (source « Cystic Fibrosis
Foundation »). Ces troubles ont pour origine la sécrétion d'un mucus trop
épais, qui bouche progressivement les canaux présents dans les organes
(bronches, canaux biliaires, canaux pancréatiques ...). Aujourd'hui la
mucoviscidose reste une maladie que l'on ne sait pas guérir. Seuls des
traitements précoces et adaptés permettent de ralentir son évolution. Le mode
de production de la lipase gastrique par les plantes pourrait être une
alternative totale ou partielle aux extraits pancréatiques de porc actuellement
utilisés et inefficaces chez environ 15% des patients atteints de
mucoviscidose. « Meristem therapeutics » a souhaité développer en
2005 cette lipase gastrique pour le traitement de la malabsorption des graisses
chez les patients atteints de mucoviscidose.[24][25]
b) Problème liés a la stabilité de la protéine recombinante
En 2003, « Meristem therapeutics » a mis en
évidence l’impact de différents ciblages sur l’expression du transgène sur la
structure et l’activité d’une lipase recombinante produite chez le tabac. [A transient tobacco expression
systeme coupled to maldi-tof-ms allows validation of the impact of differential
targeting on structure and activity of recombinant therapeutic glycoprotein
produced in plants]. La qualité d’une protéine recombinante est
largement influencée par l’élaboration de la chaîne primaire polypeptidique.
Chez les plantes, il est possible de cibler spécifiquement les protéines dans
l’espace extracellulaire (apoplasme) ou dans les organelles subcellulaire comme
la vacuole, le réticulum endoplasmique ou le chloroplaste. [26]
Le choix du ciblage subcellulaire est très important pour
élaborer la stratégie de l’expression d’une protéine donnée. Ce choix est
influencé par des paramètres technique et économique. Meristem therapeutics
a montré que le ciblage du gène codant pour la lipase gastrique dans deux
locations subcellulaires a une influence non seulement sur la structure de la
protéine mais également sur son activité catalytique. En particulier lorsque le
ciblage s’effectue dans le réticulum endoplasmique, des complexes et des
structures tronquées ont été trouvées suggérant une fuite vers d’autres
compartiments de la cellule. Ceci est dû en partie par la présence d’exoglycosidase
dans l’apoplasme.
Pour la production stable d’une lipase recombinante dans un
plant de tabac, Meristem therapeutics a choisi d’étudier chaque compartiment de
la cellule et la glycosylation site par site par l’intermédiaire de
spectrométrie de masse « maldi-tof ».[26][35]
MERISTEM Therapeutics a développé la Merispase®, une lipase
gastrique recombinante produite dans du maïs transgénique, pour le traitement
de la mauvaise absorption des lipides lié à l’insuffisance pancréatique exocrine.
Cette lipase gastrique a été sélectionnée en raison de sa résistance naturelle
à la digestion par les acides de l’estomac et parce qu’elle garde une activité
enzymatique élevée après le transit stomacal, ce qui améliore son efficacité
dans l’absorption des lipides. La Merispase® permettra à une proportion
significative de malades qui ne réagissent pas aux extraits pancréatiques
d’être soigné efficacement. De plus avec la Merispase®, il n’y a plus de risque
de contamination virale. Enfin, la posologie sera moins contraignante (moins de
cachets par jour) ce qui facilitera un meilleur traitement.[24]
La lipase gastrique a reçu le statut de médicament orphelin
en juillet 2003 délivré par l’agence européenne du médicament. MERISTEM a déjà
produit plusieurs kilogrammes de lipase gastrique de qualité pharmaceutique.
Les phases I (étude tolérance) et deux phase IIa (seul ou en complément)
se sont achevées en juillet 2004. En avril 2005 le ministère de l’agriculture
et de l’alimentation a délivré à MERISTEM Therapeutics les autorisations pour
cultiver 20 ha de maïs Merispase®dans le puy de Dôme. La Merispase® est
actuellement en phase d’optimisation de la formulation : Plusieurs
formulations de la lipase gastrique sont testées in vitro, en utilisant un
modèle de tube digestif artificiel dans le but d’améliorer la pharmacocinétique
et l’activité de la Merispase®.[24][25][37][31]
Il faut préciser que la production d’une molécule
thérapeutique dans une plante modifiée génétiquement est une première en
France. De plus l’opinion publique ne semble pas encore prête à l’accepter la
culture en plein champ d’OGM. Deux parcelles de maïs génétiquement modifié ont
été détruites.
4.
Le riz pour exprimer les terpènes du ginkgo
Gingko biloba
est un gymnosperme de la classe des conopsides et de la famille de Ginkgoaceae
originaire de l’est de la Chine et datant approximativement de 150 millions
d’année. Cette espèce est la seule représentante de son ordre. Présentée sous
le nom de « fossile vivant », elle est connue pour sa capacité à
survivre dans des conditions climatiques difficiles et de résister aux
infections d’insectes.
G. biloba est
utilisé comme une plante thérapeutique ayant un impact sur les tissus
ischémiques (tissus cérébrales) en impliquant des processus de vascularisation.
Les extraits de feuilles de G. biloba
ont été utilisés depuis plusieurs siècles pour traiter les maladies
cérébro-vasculaires et cardio-vasculaires. Ces effets bénéfiques
pharmacologiques ont été attribué en partie à une série spécifique et unique de
diterpenes : les ginkgolides. Ces molécules sont des antagonistes
spécifiques des récepteurs des facteurs activant les plaquettes (PAF). La
production des PAF a lieu lors de choc anaphylactique conduisant une
bronchio-constriction, à la contraction des muscles lisses et à une réduction
de la tension sanguines. Ces symptômes peuvent être fatales. Le ginkolides B est
l’isomère le plus connu et peut être une alternative thérapeutique pour traiter
la maladie d’Azheimer.
Actuellement le développement commercial des ginkgolides
comme agents thérapeutiques a été arrêté du fait de la topologie et des
complexités stéréochimiques de la synthèse des diterpenes. La production
actuelle de ginkgolides provient exclusivement de l’extraction des arbres de
ginkgo qui accumule très peu de ce composant.
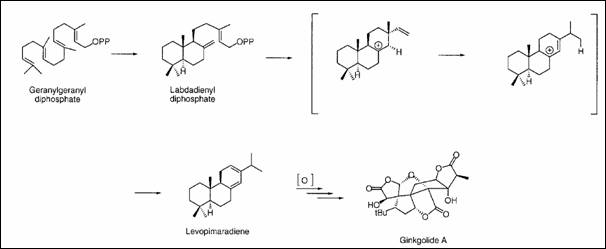
Figure 5 : voie de synthèse du
ginkgolide A à partir du géranylgéranyl diphosphate[23]
Le GGDP subit la
cyclisation protonique au diphosphate de labdadienyl. L'élimination de
diphosphate lance la cyclisation et des réarrangements cationiques qui
produisent le levopimaradiene. D’autres processus oxydatifs [O] conduise à la
formation du ginkgolide A
Matsuda et al, de l’université du riz de Houston, ont avec
succès cloné et caractérisé l'enzyme, le levopimaradiene synthase, qui catalyse
la première étape de la biosynthèse de ginkgolide. La levopimaradiene synthase
est un enzyme qui catalyse la synthèse de levopimaradiene à partir du GGDP par
l’intermédiaire d’une ionisation et d’une protonation (Voir figure 5). Ce gène
est essentiel aux approches de génétique pour surproduire des ginkgolides.
Spécifiquement, le levopimaradiene synthase est nécessaire pour produire le
levopimaradiene de précurseur de ginkgolide. Les méthodes de production
potentielles de levopimaradiene décrite sont valables que si l’organisme
génétiquement modifié possède naturellement le GGDP. La surexpression levopimaradiene
synthase permettra d’obtenir à des niveaux plus élevés des précurseurs de
ginkgolide.
Le riz apparaît comme un bon candidat pour la transformation
car il synthétise naturellement le GGDP. Par ailleurs, ce précurseur a déjà été
utilisé avec succès pour le développement du riz doré enrichi en β-carotène.
C. Avantages et inconvénients vis a vis des autres formes de production
Jusqu'à l'avènement du génie génétique, seules les protéines
obtenues par extraction à partir des organismes vivants pouvaient être utilisées
à des fins thérapeutiques. C'était le cas notamment de l'insuline extraite des
pancréas de porc, des facteurs VIII et IX de coagulation extraits du sang
humain, des anticorps etc. Cependant, certaines protéines sont si peu
abondantes qu'elles ne peuvent pas être obtenues en quantité suffisante par
extraction.[14]
1.
Production de protéines recombinantes par
les bactéries
a)
Les bactéries : des usines de
production
L'utilisation de micro-organismes pour la production de
protéines a été l'une des premières applications envisagées pour le génie
génétique. Elle permet de s'affranchir des problèmes liés à la difficulté de
purifier ces protéines à partir de leurs producteurs naturels (l'homme par
exemple), de s'assurer de l'absence de contaminants redoutés (virus, prions
entre autres) et, pour un industriel, de maîtriser totalement la chaîne de
production. [29]
Les bactéries, facilement transformables par des gènes
étrangers et cultivées depuis longtemps à l'échelle industrielle, ont été les
premiers organismes sollicités pour produire des protéines recombinantes. C'est
ainsi que désormais la majeure partie de l'insuline utilisée pour soigner le
diabète provient de bactéries recombinantes, et non plus de pancréas de porc.
La totalité de l'hormone de croissance humaine utilisée pour soigner certaines
formes de nanisme, et la totalité de l'hormone de croissance bovine, utilisée
pour augmenter la sécrétion lactée des ruminants, proviennent également de
bactéries. Ces molécules ont une excellente activité biologique et sont plus
pures que les hormones obtenues par extraction. D’autres production utilisant
des bactéries lactiques (exemple les lactocoques) des médiateurs biologiques
(hormones ou interleukines) sont associées à la prévention d'attaques virales
et leur présence induit une résistance des cellules aux pathogènes. [29]
Trois laboratoires à l'INRA ont contribué à développer des
outils qui permettent de contrôler le niveau de production des protéines, leur
localisation, après production, ainsi que leur mode de libération (sécrétion ou
éclatement des cellules). [29]
b)
Les bactéries : des vecteurs de
molécules thérapeutiques
Il existe une grande diversité de bactéries lactiques, ce
qui se traduit par une grande variété de comportements, tant au niveau
technologique qu'au niveau de la survie et du développement de ces
micro-organismes dans le tractus digestif après ingestion. [29]
Certaines espèces de bactéries lactiques peuvent subsister
plusieurs jours dans le tractus digestif. Dans ce cas, il serait nécessaire de
faire produire les substances à effet thérapeutique à l'extérieur de la cellule
puisque les bactéries ne libéreront pas leur contenu. L'emploi de telles
bactéries pourrait être souhaité dans le cas de traitements nécessitant une
action à long terme. Cependant, il faut s'assurer de l'absence d'effet
secondaire lié à la multiplication de la bactérie pendant ce long laps de
temps.[22]
Dans d'autres cas, il pourrait être préférable de choisir
des souches rapidement éliminées après l'ingestion. Les lactocoques
correspondent à cette catégorie. Il est même possible de modifier les bactéries
de manière à accélérer leur destruction par autolyse. Ces bactéries ne seraient
donc que des vecteurs des molécules produites avant ingestion sont envisagées.
Ces bactéries, pourraient, à terme, être utilisées comme vecteur de molécules
thérapeutiques. Les formules sous lesquelles ces bactéries pourraient être
administrées sont diverses, comme par exemple des comprimés ou des gélules
contenant les bactéries lyophilisées. Le faible coût de production de tels
médicaments devrait permettre de réduire certaines dépenses de santé. .[22]
Gageons que les bactéries lactiques génétiquement modifiées
permettront à plus ou moins long terme de nous protéger contre certaines
pathologies digestives aussi variées que les déficiences enzymatiques ou les
infections bactérienne ou virale, ou même les allergies.[22]
c)
Les limitations de la production par les
bactéries
Les bactéries
présentent cependant plusieurs limitations dues aux différences
physiologiques fondamentales qui existent entre la machinerie cellulaire d'une
bactérie et celle d'une cellule humaine : les protéines produites ne subissent
pas toutes les modifications caractéristiques des protéines humaines, ce qui
peut amener à leur rejet par le système immunitaire, réduire leur durée de vie
dans l'organisme voire leur activité biologique. Il est par ailleurs souvent
difficile d'obtenir leur exportation de la cellule bactérienne dans le milieu
de culture, ce qui complique leur purification [29].
2.
Production de protéines recombinantes par
les levures
L'utilisation d'autres organismes producteurs non bactériens
comme les levures vise à pallier le cas échéant ces limitations. Les levures
occupent une place particulière car elles offrent les mêmes facilités
expérimentales ou industrielles que les bactéries, en particulier culture aisée
en fermenteurs à haute densité cellulaire, tout en possédant une machinerie
cellulaire proche de celle d'une cellule humaine.
Le premier vaccin recombinant, contre le virus de l'hépatite
B, a été produit dès 1981 par Saccharomyces
cerevisiae, et agréé peu après pour la vaccination humaine. Ce vaccin est
depuis très largement utilisé à travers le monde, et en Europe en particulier.
Malgré ce succès précoce, S. cerevisiae a rapidement montré elle aussi des limites. Les
niveaux de production restent souvent peu élevés (de l'ordre de 100mg à 1g de
protéine recombinante par litre de milieu de culture), les modifications des
protéines sont souvent anormales, et surtout de nombreuses protéines ne peuvent
être exportées dans le milieu extérieur.
L'exploration d'autres espèces de levures, comme Pichia pastoris, Kluyveromyces lactis ou Yarrowia
lipolytica, qui présentent les mêmes avantages technologiques pour la
production que S. cerevisiae et les
mêmes garanties sanitaires, s'est développée considérablement au cours des dix
dernières années. Ces organismes semblent plus efficaces que S. cerevisiae, c'est à dire qu'ils
produisent plus de protéines dans le milieu extracellulaire, et ces protéines
sont plus proches des protéines naturelles. P.
pastoris, par exemple, est largement utilisée par les laboratoires pour
obtenir rapidement les protéines d’intérêt à des fins de recherche, ce qui
témoigne de sa simplicité d'usage et de sa fiabilité. Ces levures sont
cependant aussi incapables que S. cerevisiae
de réaliser des modifications caractéristiques de protéines humaines. Leur
usage se limite donc à la production des protéines pour lesquelles ces
modifications sont inutiles, et plus particulièrement à celles qui doivent être
produites en larges quantités. [12]
3.
Production de protéines recombinantes par
les cellules de mammifères
La culture de cellules de mammifères est le système standard
de production de protéines recombinantes complexes telles que les anticorps
monoclonaux. Les systèmes d’expression cellulaire permettent d’obtenir des
protéines recombinantes correctement repliées et modifiées. Cependant le faible
rendement par rapport au coût de production est un sérieux désavantage et ce
mode de production est relativement peu efficace et peu souple. [3]
4.
Production de protéines recombinantes par
les animaux transgéniques
La sécrétion dans le
sang des protéines étrangères a été envisagée en premier lieu. Des lapins ayant
dans le sang de l'alpha-1 antitrypsine humaine à la concentration de 1mg/ml ont
ainsi été obtenus il y a plusieurs années par l'INRA. Le sang ne peut
qu'exceptionnellement être une source de protéines étrangères. Ces protéines
n'ont en effet que peu de chance de pouvoir s'accumuler dans le sang car elles
sont rapidement éliminées par le foie et le rein. Beaucoup d'entre elles
peuvent par ailleurs agir directement sur l'animal et altérer sa santé. Le lait
a donc été retenu en second lieu comme source presque idéale de protéines
recombinantes. Un tel but peut être atteint assez aisément en transférant le
gène codant pour la protéine d'intérêt sous le contrôle de la région
régulatrice d'un des gènes de synthèse de protéines du lait qui va diriger
celle-ci spécifiquement dans la glande mammaire puis sa sécrétion dans le lait.
[14]
La glande mammaire est un organe qui produit naturellement
de grandes quantités de glycoprotéines complexes (en moyenne 140g de protéines
totales par litre de lait pour le lapin). Ces protéines assurent principalement
un rôle nutritif pour les nouveaux nés. En plus les cellules épithéliales de la
glande mammaire possèdent la machinerie cellulaire nécessaire à la synthèse, au
repliement et à l'assemblage de glycoprotéines complexes. Elles peuvent
notamment réaliser les modifications post-traductionnelles telles que les
glycosylations ou les gamma-carboxylations. Pour de nombreuses protéines
recombinantes d'origine humaine, ces modifications post traductionnelles sont
indispensables pour garantir son activité biologique et des caractéristiques
pharmacocinétiques appropriées. [3]
Une nouvelle branche de l'industrie pharmaceutique basée sur
ce procédé est en train de naître. Plusieurs protéines sont actuellement
soumises à des tests cliniques de phase I, II et III et devraient être mises
sur le marché dans les années qui viennent. Sont actuellement en cours de
développement l’uricase pour le traitement de l’hyper-uricémie, la lactoferrine
(aux propriétés anti-bactériennes), une antitrypsine (déficience congénitale en
antitrypsine), un thrombolytique (tPA)….[14]
Les travaux réalisés à l'INRA sur les gènes de protéines du
lait ont permis de mettre en oeuvre ce procédé. La région régulatrice des gènes
des protéines du lait de lapin a été brevetée à cet effet. Plusieurs protéines
ont ainsi été produites dans le lait de souris et de lapin.
Les animaux transgéniques représentent dès lors une
excellente solution alternative pour produire des vaccins recombinants ou des
protéines thérapeutiques complexes, correctement glycosylées et repliées. Ils
permettent en effet de combiner à la fois les niveaux d’expression rencontrés
dans les systèmes bactériens et les modifications post-traductionnelles
obtenues en culture cellulaire, tout en offrant des coûts de production plus
faibles que les systèmes d’expression cellulaires. Ils sont les seuls qui
pourraient permettre la production d'anticorps
recombinants à des coûts aussi faibles que ceux estimés pour les plantes
transgéniques. [3] L'efficacité de ce système de production est
largement documentée puisqu'une centaine de protéines recombinantes ont déjà
été produites dans le lait d'animaux transgéniques [10]
La maîtrise des cellules souches embryonnaires de poulet
acquise récemment par l'INRA laisse envisager la possibilité de préparer des
protéines recombinantes dans le blanc d'oeuf.[13] D'autres procédés peuvent conduire à la synthèse de
protéines recombinantes. C'est le cas notamment des cellules d'insectes
infectées par un baculovirus portant le gène qui code pour la protéine
d'intérêt. [3]
a)
L’exemple de production dans le lait de
lapine :
Le lapin est phylogéniquement plus proche des primates que
ne le sont les rongeurs, ils ont des faibles coûts d’élevage. Ceci permet aux
sociétés comme « BioProtein Technologies » de réduire
significativement le coût de production des protéines thérapeutiques. Il
n’existe pas de maladies sérieuses connues chez le lapin qui soient transmissibles à l’homme. Toutes ces propriétés
font du lapin un système d’expression plus sûr que la vache, la chèvre ou la
brebis. Les lapins constituent dès lors un formidable bio-réacteur permettant
de produire dans des délais très compétitifs des protéines recombinantes à
usage thérapeutique. [3]
La production d’une protéine dans le lait peut être obtenue
en transférant chez le lapin un transgène associant le gène codant la protéine
d’intérêt et un promoteur spécifique de la glande mammaire (promoteur du gène
WAP Whey Acidic Protein). D’autres éléments régulateurs comme des
amplificateurs et des isolateurs sont associés et participent au contrôle du
taux d'expression du gène. Le transgène est par ailleurs protégé par une
licence exclusive de l’INRA.[29]
Les lapins transgéniques sont obtenus par une méthode de
micro-injection, où le vecteur d'expression est directement injecté dans le
pro-noyau d'un ovocyte unicellulaire fertilisé. Les embryons transgéniques sont
alors transplantés dans une femelle lapine receveuse et les animaux
transgéniques produits montrent une expression stable du transgène d'une
génération à l'autre. [3]
Cette technique permet de produire des protéines
recombinantes thérapeutiques telles que des protéines plasmatiques,
anticorps monoclonaux, hormones, peptides. En fonction du niveau d’expression
du gène, la concentration en protéine recombinante est comprise entre 1 et 10 g
par litre de lait. [3]
Le lapin est aussi utilisé pour produire des vaccins
multivalents basés sur l'utilisation de VLP (Virus-Like Particles) du
Rotavirus. Les particules pseudovirales du Rotavirus (VLPs-Rotavirus) sont des
complexes protéiques de haut poids moléculaire constitués de centaines de protéines
de deux types : VP2 et VP6. Ces protéines, qui sont issues de la capside virale
du Rotavirus, s’assemblent spontanément pour former des particules
pseudovirales ayant une structure semblable à celle du Rotavirus. Ces
particules présentent la même capacité à stimuler le système immunitaire que le
Rotavirus, mais permettent d’éliminer le risque infectieux lié à
l’administration d’un virus entier. Les VLPs-Rotavirus constituent des vecteurs
d’antigènes efficaces du fait de leur haut poids moléculaire et de la
répétition des motifs antigéniques présents dans chaque particule. L’injection
du lactosérum provenant de ce lait à des souris a induit la sécrétion
d’anticorps spécifiques dirigés contre les protéines de capside. [3] [29]
Les lapines sont traites mécaniquement dans une salle de
traite confinée. Afin de récupérer le lait, il est directement filtré sur une
membrane 0,22 µm, clarifié (lipides et caséines sont retirés) et stocké dans
des poches plastiques stériles à -20°C en conditions GMP (Good Manufacturing
Practice) avant d'être purifié. [3]
b) Limites de la production par les animaux
Toutefois, ces systèmes de production par les animaux
transgéniques présentent aussi des limites bien connues puisque la production
de certaines protéines recombinantes, et en particulier d'anticorps
thérapeutiques, risque de perturber le métabolisme de l'animal transgénique. De
plus, contrairement aux protéines recombinantes d'origine végétale qui ne
peuvent être contaminées par des agents pathogènes pour l’homme, un doute
persiste concernant les risques de contamination d'une molécule pharmaceutique
issue d'animaux transgéniques par des pathogènes transmissibles à l'homme. [29]
5.
Comparaison des différentes systèmes
d’expression
Le tableau 2 permet de résumer les différentes approches
mentionnées précédemment. En étudiant les différents critères, la production de
protéines recombinantes par les plantes semble être la plus adéquate. Les
plantes aurait l’avantage de ne pas contenir de pathogène transmissible à
l’homme, la quantité de protéines produite est largement supérieur au organisme
unicellulaire pour un coût de production plus faible.
Tableau 2 : Comparaison des
différents systèmes de production de protéines recombinantes [8]
|
Système expression |
Avantages |
Désavantages |
Applications |
Coût/g |
|
Bactéries |
Voie de régulation établie;
la génétique bien comprise; bon marché et facilitée de développement |
Les protéines non
habituellement sécrétés; Contiennent
endotoxines; pas modifications post-traductionnelles |
Insuline (E. coli); hormone
de croissance (Genentech); facteur de
croissance ; interféron |
200 – 3000€ |
|
Levure |
Reconnu sans
risque, Longue histoire d’utilisation ; rapide; peu coûteuse;
post-traductionnelles modifications |
La sur glycosylation peut
modifier la bioactivité et la sécurité; Peut contenir
des immunogènes/antigènes |
fermentation; vaccins
recombinants contre le virus hépatite B
insuline humaine |
50–100€ |
|
Cellules d’insecte |
Modifications
post-traductionnelles; Protéines correctement
formées; niveau assez élevé d’expression |
Faible voie de régulation;
croissance lente; moyen assez coûteux; Infection au bacillo-virus; virus de
mammifères peuvent infecter les cellules |
Novavax production de
particules virales |
|
|
Cellules Mammifères |
Protéines correctement
formées; modifications post-traductionnelles correctes; bonnes connaissances
des voies de régulation; le seul choix pour les grosses protéines |
Moyen coûteux; croissance
lente Peut contenir des
allergènes/contaminant; purification compliquée |
activateur tissue
plasminogène; facteur VIII (glycoprotéine); anticorps monoclonal (Hercepin) |
500-5,000€ |
|
Animaux Transgénique |
Processus utiles pour
protéines complexes; Très haut niveau d’expression; coût de production faible |
Peu d’expérience dans la
régulation ; contamination virales possibles;
isolation dans les fermes |
Lipase (mouton, lapin ; PPL
Therapeutics); hormone croissance (chèvres; Genzyme); facteur VIII (bétail) |
20–50€ |
|
Plantes Transgénique |
Court cycles de
développement; Stockage facile; bon niveau d’expression; pas de virus connue
chez les plantes qui infecteraient les humains |
Potentiel pour de nouveaux
contaminants (champignon, bactéries, pesticides); modifications
post-traductionnelles; peut contenir des allergènes |
Vaccins pour le choléra
(tabac;Chlorogen, Inc.); lipase gastrique (maïs; Meristem); hepatite B (pomme
de terre; Boyce Thompson) |
10–50€ |
(Elbehri, Biopharming and the
Food System: Examining the Potential Benefits and Risks AgBioForum, 8(1):
18-25. 2005)
Les systèmes utilisant des plantes transgéniques permettent
de produire des protéines en quantités très importantes. Cependant, cultivés en
milieu « ouvert », les risques sont de plusieurs ordres. Il peut
s’agir de contaminations physico-chimiques (pesticides…) ou biologiques
(mycotoxines, transmission de virus animaux par les déjections) provenant de
l’environnement, ou encore de virus végétaux dont, cependant, la possibilité de
transmission et de pathogénicité vis-à-vis de l’homme n’a jamais été décrite
jusqu’à présent. Ils peuvent également poser des problèmes d’allergies ou de
néo-antigénicité en raison des différences de glycosylations des protéines
végétales et des protéines animales. Enfin, le risque de dissémination dans
l’environnement d’une plante transgénique codant pour une protéine-médicament
ne semble pas majeur, même s’il ne doit pas être écarté. [10]
A l’instar des autres médicaments, tous les principes actifs
obtenus par ces diverses modalités doivent faire l’objet d’une évaluation
détaillée avant d’être autorisés pour être utilisés en thérapeutique humaine.
Les critères utilisés dans cette évaluation sont ceux préconisés pour octroyer
une AMM portant sur la pureté et la qualité du produit, la sécurité et
l’efficacité cliniques, le rapport bénéfices / risques. [13]
Il est vraisemblable qu'au siècle prochain, tous ces
systèmes de production seront mis en oeuvre. L'utilisation d'un procédé plutôt
qu'un autre sera déterminée par son efficacité au cas par cas. Des protéines
pour la médecine humaine et vétérinaire, ainsi que pour le diagnostic, seront
ainsi mis à la disposition des hôpitaux, des laboratoires d'analyse et des
élevages. [14]
Les organismes vivants sont utilisés comme des usines de
production qui permettent de valoriser une ressource génétique particulière.
Cependant, il est nécessaire de s’interroger a propos de l’appropriation de
cette ressource notamment lorsqu’il s’agit d’un gène spécifique à une plante
locale comme dans l’exemple du Gingko
biloba. C’est d’ailleurs cet aspect « locale » qui pose la
question des détenteurs vis à vis de cette molécule thérapeutique.
II.La production des
molécules à effets thérapeutiques : la question des détenteurs
A. L’appropriation des ressources génétiques
1.
Droit à la propriété intellectuelle
Les ressources génétiques dans le domaine végétal ont de
tout temps été considérées comme Patrimoine Commun de l’Humanité. C’est encore
le cas avec l’engagement international de la FAO signé en 2001. Cependant ce
libre accès est limité à une liste d’espèces. Les espèces ne figurant pas sur
cette liste doivent être gérées par la Convention de la Biodiversité. [37]La CBD, entrée en vigueur en 1993, a trois
objectifs : la conservation de la diversité biologique, l’utilisation
durable de ses éléments et le partage juste et équitable des avantages
résultant de l’exploitation des ressources génétiques. Au-delà des principes
généraux comme celui de la souveraineté nationale sur les ressources
biologiques, la CBD est très peu précise sur sa mise en œuvre. C’est
principalement sur le 3ème objectif de partage des avantages que se focalise le
débat international, selon un axe nord-sud dont l’enjeu est l’accès aux
ressources génétiques in situ dans les pays riches en biodiversité. Le partage
des avantages est traité dans l’article 15 de la CBD sur l’accès aux
ressources génétiques « Chaque
Partie contractante prend les mesures législatives, administratives ou de
politique générale appropriées,…, pour assurer le partage juste et équitable
des résultats de la recherche et de la mise en valeur ainsi que des avantages
résultant de l’utilisation commerciale et autre des ressources génétiques avec
la Partie contractante qui fournit ces ressources. Ce partage s’effectue selon
des modalité mutuellement convenues » et en lien particulier avec la
biotechnologie dans l’article 19 « Chaque
Partie contractante prend toutes les mesures possibles pour encourager et
favoriser l’accès prioritaire, sur la base juste et équitable, des Parties
contractantes, en particulier des pays en développement, aux résultats et aux
avantages découlant des biotechnologies fondées sur les ressources génétiques
fournies par ces Parties » [1][2][34]
2.
Evolution du droit de propriété
intellectuelle
a) Certificat d’obtention végétale et brevet
La première loi de protection des obtentions végétales a été
adoptée aux Etats-Unis du XXème siècle. L’accélération des échanges mondiaux a
conduit à l’adoption d’une réglementation internationale dans le cadre de la
convention de Union pour la Protection des Obtentions Végétales (UPOV) en 1961.
L’UPOV compte aujourd’hui 49 Etats membre, essentiellement des pays développés
et des pays en développement tournés vers l’exportation. La convention de
l’UPOV a instauré les Certificats d’Obtentions Végétales (COV) qui permet la
protection des variétés. L’une des caractéristiques des COV c’est l’exemption de
la recherche, qui permet l’utilisation libre d’une variété à des fins de
recherche par des sélectionneurs même concurrents pour l’obtention d’une
nouvelle variété. Ce certificat permet le libre accès génétique tout en
protégant les innovations.[5] Parallèlement au système des COV, s’est développée,
aux Etat-Unis la protection des obtentions végétales par le brevet. Le brevet
ne pouvait être accordé que si la demande répondait à des critères stricts :
nouveauté, inventivité, application industrielle. Il confère au détenteur un
droit exclusif d’exploitation pour un temps déterminé (maximum de vingt ans) il
interdit tout usage du procédé ou du produit par une tierce personne ; le
titulaire du droit peut autoriser un tiers à l’utiliser contre le payement de
redevance. Le brevet a un double objectif. Il incite à l’innovation puisqu’il
donne au détenteur du brevet un pouvoir de monopole, mais ce pouvoir et limité
dans le temps pour l’inciter à investir dans la recherche & développement.
Il assure une diffusion de l’innovation puisque le descriptif de l’innovation
et publique.[6] La question de la propriété des données brutes et des
faits est désormais un nouvel enjeu fondamental du débat sur l’évolution de la
propriété intellectuelle.
b) Position de la recherche publique et notamment de l’INRA vis-à-vis du
brevet
L'émergence des biotechnologies qui ont fait du brevet le
mode de valorisation de leurs activités, a obligé l'I.N.R.A. à faire évoluer sa
pratique de valorisation de ses recherches et à adopter une politique de
propriété industrielle.
Il est toujours difficile pour un organisme public de
recherche d'adopter des méthodes utilisées par des entreprises privées car il
existe la possibilité de dérives qui risquent de lui faire perdre tout
caractère public et, partant, de lui ôter tout légitimité à bénéficier de
financements collectifs.
Cependant mettre les résultats de la recherche dans le
domaine public revient à les mettre gratuitement à la disposition de tous, et
donc aussi à celle des entreprises multinationales concurrentes. Cela
reviendrait à leur permettre de développer des innovations qui ne manqueraient
pas d'être protégées par brevets. Il y aurait ainsi une captation illégitime
des travaux de l'I.N.R.A. [5]
Conscient de ces difficultés, l’I.N.R.A. a conduit une
réflexion sur ce thème de la portée des brevets dans son action. Cette démarche
l'a conduit à solliciter son Comité d'éthique et de précaution (COMEPRA).
Celui-ci a adopté un avis sur ce thème le 31 janvier 2002. [15]
Le Conseil scientifique de l'I.N.R.A. s'est ensuite prononcé
le 9 octobre 2002 sur ce thème et son Conseil d'administration a finalement
adopté une Charte de la propriété intellectuelle le 19 juin 2003.
Les principaux points de
cette charte sont les suivants [15]:
Ø
De façon générale, soutien du
système du certificat d'obtention végétale (C.O.V.) pour la protection des
variétés végétales,
Ø
le brevet doit être considéré
comme un compromis permettant à la fois la diffusion et la protection des
connaissances,
Ø
pas de dépôt de brevet couvrant
des séquences génétiques sauf quand leur fonction biologique aura été démontrée
expérimentalement ; dans ce cas les revendications seront limitées aux
applications concrètes et identifiées correspondant aux missions de l'institut,
Ø
pas de « brevets de
produits » car ils sont considérés comme des monopoles abusifs,
Ø
en cas de copropriété de résultats
avec un organisme public, définition de cette propriété selon des conventions
cadres,
Ø
en cas de copropriété de résultats
avec des partenaires privés :
Ø
principe de la revendication
systématique de la pleine propriété des résultats obtenus, les partenaires
pouvant bénéficier d'un droit de première information ou d'option de licence
Ø
copropriété des résultats pouvant
être acceptée si la participation du partenaire le justifie
Ø
dévolution entière de la propriété
des résultats obtenus qu'à titre tout à fait exceptionnel et seulement possible
pour des applications sans caractère générique ou stratégique pour l'Institut.
Ø
la concession de licences non
exclusives est privilégiée
Ø
caractère exceptionnel des
licences exclusives dont la durée est limitée, les domaines d'application et
géographique bien définis.
Cette charte semble juste car elle prône avec intérêt
l’utilisation de licences non exclusives tout en gardant la propriété des
résultats obtenus en partenariat avec la recherche privée. Toute la question
est de réussir une synergie avec les partenaires privées. C’est ainsi qu’en
1999, le Génoplante fut crée regroupant des acteurs de la recherche publique
(I.N.R.A., C.N.R.S., C.I.R.A.D., I.R.D.) et privée (Biogemma, Bioplante
et Bayer CropScience). [5]
3.
Croissance des brevets dans le domaine du
vivant
Depuis le début des années 70, les sciences écologiques ne
sont les plus les seules à s’intéresser à la diversité biologique. Le premier
brevet pour un micro-organisme génétiquement modifier est accordé en 1980
(Chakrabarty, Etats-Unis). Les brevets s’étendent ensuite aux plantes et aux
animaux transgéniques. Les premières applications commerciales suivent, le
nombre d’entreprises en biotechnologie s’accroît et plusieurs d’entre elles
entre en bourse. Ce boum des biotechnologies stimule la recherche appliquée
dans les secteurs de la pharmacie, de l’agriculture et de l’industrie.
Conçus à l’origine pour les inventions industrielles sur des
matières inanimées, les droits de propriété intellectuelle (DPI) sont
progressivement étendus au matériel génétique animal et végétal. Facilités par
de nouvelles législations nationales, les dépôts de brevets sur les
biotechnologies se multiplient cette multiplication de droits pose des
problèmes de commerce international. Les niveaux de protection variant entre
les pays, des comportements protectionnistes se développent.
Cette croissance a été marquée à la fois dans les demandes
et dans les délivrances de brevets. La figure 5 donne l’évolution des brevets
accordés par année par l’U.S.P.T.O. en biotechnologie de 1989 à 2002.
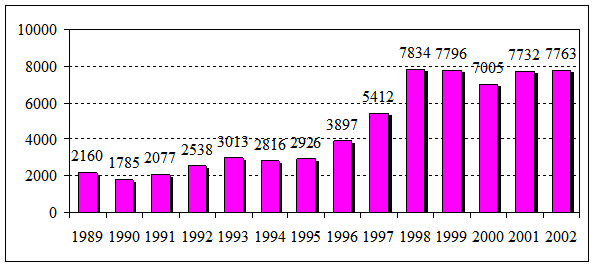
Figure 6 : Nombre de brevets accordés par an Source : USPTO
Le nombre de ces brevets est passé de 2 160 en 1989 à 7 763
en 2000, ce qui représente une augmentation considérable. Le nombre de brevets
accordés a commencé à croître de façon importante en 1996 pour s’établir à plus
de 7 000 par an à partir de 1998. Cette augmentation du nombre des brevets est
due à l’émergence des petites entreprises de biotechnologie.[6]
Les petites entreprises de biotechnologie sont nées d’un
changement de la politique des brevets aux Etats-Unis au début des années 1980,
du développement de la génétique médicale et des difficultés éprouvées dans
leur stratégie de recherche par les grandes entreprises pharmaceutiques. Depuis
le début des années 1980, les grandes entreprises pharmaceutiques ont
progressivement éprouvé des difficultés croissantes caractérisées par un
vieillissement de leurs portefeuilles de produits, une augmentation des coûts
de développement et de la durée de recherche et une diminution des mises sur le
marché des médicaments innovants. Cette hausse des coûts de recherche et cette
diminution des mises sur le marché de nouveaux médicaments se constatent sur la
figure suivante :
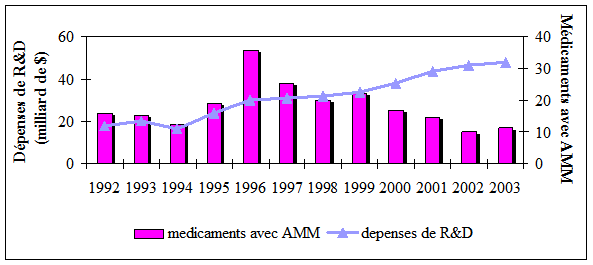
Figure 7 : la R&D américaine en panne de
nouveaux médicaments Source :PhRMA
et FDA
4.
L’appropriation du vivant est permise par
l’affaiblissement des critères classiques de la brevetabilité
On rappellera que, classiquement, les critères de fond de
brevetabilité sont au nombre de trois : la nouveauté, l’inventivité et
l’application industrielle. [5][6][27]
a) La nouveauté :
Une invention est considérée comme nouvelle si elle n’a pas
été divulguée, avant la date de dépôt de la demande de brevet, par une
description écrite ou orale, un usage ou tout autre moyen ;
Selon l’acception courante une invention concerne un objet
nouveau, c’est à dire qui n’existait pas antérieurement à l’état naturel et
dont la création est donc artificielle.
La question qui se pose dans ce domaine est de savoir si un
gène, ou une protéine, présent dans la nature est ou pas à la disposition du
public. Les gènes ne sont naturellement pas directement accessibles et il est
évident qu’un travail est nécessaire pour les isoler. Mais est-ce suffisant
pour considérer que cela permette de conclure à la nouveauté ? Les gènes
préexistant évidemment à toutes les caractérisations permet d*fortement d’en
douter.
La « solution » des juristes et des offices de brevet a été
de rattacher la génomique au génie chimique en établissant une équivalence
entre les molécules d’ADN et les molécules chimiques. Cette conception est
présente depuis longtemps dans les directives d’examen de l’Office européen des
brevets. Une matière biologique isolée de son environnement naturel ou produite
à l’aide d’un procédé technique peut-être l’objet d’une invention, même
lorsqu’elle préexistait à l’état naturel.[39]
b) L’inventivité :
Une invention est réputée inventive ne découlant pas, pour
un homme de métier, de manière évidente de l’état de la technique ;
L’inventivité renvoie à la capacité d’inventer, d’innover. Elle s’oppose à la
découverte.
Deux distorsions du sens du mot « invention » sont apparues
dans ce domaine du vivant : l’une concerne la distinction entre invention et
découverte et l’autre la réalité du travail effectué sous ce vocable. La notion
d’invention a donc été étendue à tout travail d’isolement des choses naturelles
qui sont décrites, manipulées, isolées et reproduites.[39]
c) L’application industrielle :
L’invention est considérée comme susceptible d’application
industrielle dont l’objet peut être fabriqué ou utilisé dans tout genre
d’industrie. Il y a un grand débat pour savoir si les séquences génétiques,
sous leurs formes variées, peuvent satisfaire le critère d’application
industrielle ou d’utilité. Le développement des techniques automatiques a
permis de connaître des quantités de séquences d’A.D.N. sans que l’on sache
quelles étaient leurs fonctions. Des brevets n’en ont pas moins été délivrés
sur des gènes ou des parties de gènes sans que la moindre information ait été
fournie sur leur application ou leur utilité réelles.
On peut donc estimer que le critère d’application
industrielle (ou d’utilité) en matière de vivant ne semble plus avoir beaucoup
d’importance par rapport au critère de la « fonction », au moins tel qu’il est
entendu par les offices de brevet.
L’appréciation des trois critères de fond, ainsi que des
revendications, a fait l’objet d’une évolution telle qu’elle a rendu possible
l’appropriation du vivant.
Le propriétaire d’un gène
peut acquérir le contrôle de toutes ses fonctions et de toutes les
applications que permettront ces fonctions même si celles-ci restent pour
l’essentiel inconnues au moment où le brevet est accordé. La conséquence est
qu’une nouvelle fonction découverte, après la délivrance du brevet, sera
considérée comme complètement dépendante du brevet initial.[39]
5.
Conséquences des l’appropriation du
vivant sur les plans économique
Le brevet conçu comme une incitation à la recherche peut
devenir dans le domaine du vivant, un obstacle à celle-ci. Cela impose de
réaffirmer l’exemption de la recherche et nécessite d’explorer les voies qui
permettraient d’éviter le blocage. Comme on le sait, celui-ci donne un monopole
temporaire aux auteurs d’inventions en leur permettant d’exclure autrui de leur
commercialisation. Il contribue ainsi à rémunérer leurs efforts et leur prise
de risque tout en permettant, par la publication, la diffusion des savoirs. Par
là il constitue une authentique incitation à l’innovation et aux progrès.
Le brevet sur le vivant induit des obstacles à la recherche
dans le domaine du vivant. Les principaux sont liés à l’accumulation de
brevets, à l’existence de redevances en cascades, aux brevets larges, à la
fragmentation des droits de propriété, et aux revendications sur les inventions
en aval.
a) L’accumulation de brevets
L’accumulation de brevets caractérise une situation où de
multiples acteurs détiennent de multiples brevets. La recherche et le
développement peuvent ainsi être pénalisés compte tenu de la difficulté et du
coût d’obtention des droits nécessaires. L’exemple du « riz doré » en est une
bonne illustration. Celui-ci est un riz modifié génétiquement par ajout de
trois gènes pour augmenter la synthèse du bio-carotène et augmenter sa teneur
en vitamine A. Il était destiné aux populations de pays en développement dont
cette graminée constitue l’alimentation de base. Outre l’emploi des trois gènes
qui appartenaient à des propriétaires différents, la réalisation de cette
plante a nécessité l’utilisation d’un certain nombre de vecteurs de
transformation, promoteurs, marqueurs de résistance à des antibiotiques qui
faisaient tous l’objet de brevets. Il a été ainsi relevé que la fabrication de
cette plante faisait intervenir plus de 70 brevets appartenant à une douzaine
de propriétaires.
b) Les redevances en cascade
Comme citée auparavant, la brevetabilité s’est étendue, au
delà des gènes, à toutes les techniques intervenant dans ce domaine : lignées
cellulaires, sondes d’ADN, modèles animaux, méthodes d’analyses biologiques,
vecteurs divers qui seront employés en thérapie génique… Au-delà de ces brevets
portant sur des outils de recherche « amont », il existe d’autres types de
brevets portant par exemple sur des composés identifiés par une méthode de
dépistage ou pouvant se lier à un enzyme ou récepteur déterminé.
Une recherche avancée en biotechnologie implique en général
l’emploi de toutes ces techniques. Quand celles-ci sont brevetées, ce qui est
devenu la règle pour le plus grand nombre des cas, il faut acquérir une licence
d’utilisation auprès de chaque détenteur. Les licences imposent une redevance
annuelle fixe ou calculée selon le degré d’utilisation, par exemple le nombre
de fois où la technique en question est employée. Les prix demandés peuvent
alors être très dissuasifs.
c) Les brevets larges
Ce type de brevet réserve ainsi à son titulaire des domaines
d’exclusivité extrêmement importants qui contraignent d’éventuels compétiteurs
à solliciter des licences de dépendance dont l’obtention n’est jamais
automatique ou qui peut se faire à des conditions financières.
d) La fragmentation des droits de propriété
Cette situation est caractérisée par l’existence de droits
de propriété sur des biens indivisibles. Chaque partie est ainsi propriétaire
d’une portion du bien indivisible et a donc le droit d’exclure les autres de sa
part. Le résultat final est que personne ne possède le privilège d’utilisation
effectif, les droits étant morcelés.
e) Les revendications sur les inventions en aval
Les brevets sur les outils de recherche (marqueurs, tests,
récepteurs, animaux transgéniques…) sont de plus en plus souvent assortis de
clauses reconnaissant à leurs propriétaires des droits sur les produits
élaborés et les résultats trouvés par les outils ou les méthodes brevetées. Dès
lors le détenteur des brevets en question est fondé à demander des redevances
sur la vente d’un produit mis au point à l’aide de son outil de recherche
breveté.
B. Situation des détenteurs des ressources génétiques
La situation des pays en voie de développement est
caractérisée par une grande richesse à la fois en biodiversité et en savoirs
traditionnels dont l’accès est sujet à controverse compte tenu notamment des
droits des communautés autochtones. L’accès à la biodiversité et aux savoirs
traditionnels des pays en voie de développement a évolué au niveau
international.[5]
1.
L’évolution du cadre international : de
la liberté totale de l’accès à l’affirmation de la souveraineté nationale
Les ressources génétiques ont été de tout temps considérées comme le patrimoine commun de l’humanité c’est-à-dire que leur accès était totalement libre. Cette position n’avait cependant jamais été affirmée dans un texte et n’a pendant très longtemps fait l’objet d’aucun débat. L’Organisation des Nations Unies pour l’agriculture et l’alimentation (F.A.O.) a été créée en octobre 1945 pour améliorer l’état nutritionnel, le niveau de vie, la productivité agricole et le sort des populations rurales en général. Son action a visé à organiser un Système mondial de conservation et d’utilisation des ressources phytogénétiques au moyen de la coopération internationale.
Dans la logique de cette action la Conférence internationale de la F.A.O. a adopté en 1983 l’«Engagement international sur les ressources phytogénétiques ». La particularité de cet Engagement était d’être le premier accord international centré sur les questions de la conservation et de l’utilisation durable des ressources phytogénétiques utiles à l’agriculture et à l’alimentation. Ce texte était fondé, comme le proclamait son article premier sur « le principe universellement accepté selon lequel les ressources phytogénétiques sont le patrimoine commun de l’humanité et devraient donc être accessibles sans restriction ». Ce concept du libre accès s’étendait alors aux plantes cultivées traditionnellement, sous réserve des dispositions de l’Union pour la protection des obtentions végétales (U.P.O.V.) en vigueur dans un certain nombre de pays, et aussi, et surtout, aux espèces végétales sauvages.
L’abandon du concept de ressources génétiques « patrimoine commun de l’humanité » est la
conséquence tout d’abord du préambule de la CBD.[32] En effet celui-ci affirme seulement que « la conservation de la diversité biologique
est une préoccupation commune à l’humanité ». Deux dispositions de ce
texte, les alinéas 1 et 5 de l’article 15 expriment le changement de
préoccupations :
Article 15 – 1. : «
Etant donné que les Etats ont droit de souveraineté sur leurs ressources
naturelles, le pouvoir de déterminer l’accès aux ressources génétiques
appartient aux gouvernements et est régi par la législation nationale. »
Article 15 – 5. : «
L’accès aux ressources génétiques est soumis au consentement préalable donné en
connaissance de cause de la Partie contractante qui fournit lesdites
ressources, sauf décision contraire de cette Partie ».
Une autre disposition, l’article 15 – 7, prévoit « […] le partage juste et équitable des
résultats de la recherche et de la mise en valeur ainsi que des avantages
résultant de l’utilisation commerciale et autre des ressources génétiques avec
la Partie contractante qui fournit ces ressources. Ce partage s’effectue selon
des modalités mutuellement convenues. » [1]
C’est cette disposition, avec le mécanisme de financement,
qui a provoqué l’hostilité des Etats-Unis qui ont signé cette Convention le 4
septembre 1993 mais ne l’ont pas, jusqu’à présent, ratifiée. L’affirmation par
cette Convention de la propriété des Etats sur leurs ressources génétiques a
suscité et continue à soulever des oppositions de fond. [32]
La « bioprospection », définie comme la recherche, l’exploitation, l’extraction et le criblage de la diversité biologique et des connaissances indigènes pour découvrir des ressources génétiques ou biochimiques a donc été de toutes les époques. Elle s’est même organisée de façon systématique après 1945 sous l’égide de la F.A.O. quand prévalait le principe que les plantes faisaient partie du patrimoine de l’humanité et étaient donc librement accessibles à tous.
Un certain nombre d’entreprises et même d’institutions de recherche ont cherché à s’en assurer la propriété sans demander le consentement des pays ou des populations intéressés. Cette situation a donné lieu à la création, par des pays en voie de développement et des organisations les soutenant, du concept de « biopiraterie ». Celle-ci peut se définir comme l’usage non autorisé des ressources génétiques et des savoirs traditionnels.[6][36]
Une des premières a concerné le neem, ou margousier, originaire d’Inde qui possède de multiples propriétés insecticides, médicinales et cosmétiques. Une entreprise américaine, W.R. Grace, a obtenu, en 1990, des brevets exploitant ces caractéristiques. Le gouvernement indien a réussi à obtenir, en 2000, de la part de l’O.E.B. la révocation d’un brevet accordé pour un fongicide dérivé des graines de cette plante.
D’autres cas semblables ont eu lieu. Ainsi un brevet a été
obtenu par deux chercheurs de l’Université du Colorado sur le quinoa, une
céréale originaire des pays andins très riche en protéines, et connue depuis
très longtemps. De même le curcuma, une racine originaire d’Inde et possédant
des qualités médicinales qui a fait l’objet de demandes de brevet en 1995 par
des chercheurs de l’université du Mississippi. Un cas très récent a concerné un
maïs à haute teneur en huile et en acide oléique pour lequel un brevet avait
été accordé par l’O.E.B. à Du Pont en 2000. Suite à une action en opposition du
gouvernement du Mexique, pays d’origine du maïs, et d’un certain nombre
d’associations, ce brevet a été révoqué en février 2003 dans la mesure où
l’antériorité de la connaissance des propriétés de cette plante a pu être prouvée.
[27][5][36]
2.
Les droits des communautés autochtones
Dans les années 80, recherche et produits issus des biotechnologies
se concentre dans les pays du Nord, principal marché de la pharmacie et de
l’agrochimies. Malgré leurs importants gisements de biodiversité, les pays du
Sud bénéficient très peu de ces innovations. Les négociations sur la diversité
biologique leur donnent l’occasion de défendre leurs intérêts. Au nom de leur
souveraineté nationale, ils revendiquent le contrôle de leurs ressources
biologiques et exigent des contreparties à la fourniture de matériel génétique.
Les négociations tournent alors au marchandage entre pays à faibles revenus et
pays détenteurs de hautes technologies. En 1991, un événement extérieur aux
négociations –le contrat Merck- INBio– va signer définitivement l’abandon du
concept de patrimoine commun dans la convention et le choix de la régulation de
l’accès aux ressource et du partage des avantages. [32]
Merck- INBio crée un contrat annonçant le principe de
souveraineté nationale. En septembre 1991, l’une des plus grandes entreprises
pharmaceutiques mondiales, Merck, passe un contrat pour la valorisation de la
biodiversité avec l’Institut national de la biodiversité du Costa Rica 5INBio),
organisation nationale privée à but non lucratif. INBio, cofinancée à hauteur
de 1,135millons de dollars par Merck, est chargée, en accord avec le
gouvernement, de l’inventaire des espèces sauvages de plants, d’insectes et de
microorganismes du Costa Rica. Les échantillons biologiques sont ainsi
centralisés. En cas d’exploitation fructueuse, Merck reverse à INBio entre 2 et
6% des bénéfices. Sur le total des droits perçus, INBio en verse 50% au parc
national pour des actions de conservations. Cependant Merck conserve
l’exclusivité d’exploitation des échantillons pendant deux ans et le droit de
déposer un brevet pour tous produits développés à partir des échantillons.
Révélé en 1991 au moment où les négociations sur la convention butent sur les
conflits d’accès aux ressources se contrat apparaît comme un modèle de gestion
rationnelle de la biodiversité conciliant les intérêt du nord et du sud.
Cependant la décision de dénoncer en 2002 cet accord faute
de débouchés commerciaux, tend à montrer les limites des financements
mobilisables par ce biais. Dans la pratique, la définition de lois nationale
sur l’accès et le partage des avantages reste complexes. Plusieurs ensembles
régionaux ont donc formulé d’un régime commun d’accès aux ressources génétiques
(Pacte andin, OUA et ASEAN). Ces législations déterminent les procédures à
suivre par les scientifiques et les entreprises du pays ou de l’étranger pour
accéder aux ressources. Elles spécifient aussi les conditions du partage des
avantages.
En l’absence de législation nationale, la protection des
communautés locales et des savoirs traditionnels n’est pas toujours garantie.
La Convention de la Biodiversité s’est munie d’un groupe de travail sur l’accès
et le partage des avantages. La convention souligne le lien entre la
conservation de la biodiversité et de la diversité culturelle et de
l’importance de l’implication des communauté locales dans les accords de
partage des avantages, l’article 8j) ouvre le débat sur les formes de protection
des savoirs traditionnels et sur la possibilité de faire valoir des droits tant
sur les savoirs que sur les innovation. Leur reconnaissance devrait assurer
plus d’équité dans le partage des avantages.[32]
La convention de la biodiversité pose les règles d’accès et
de partages. Cependant la principale difficulté rencontrée reste la protection
des droits des populations autochtones et locales puisque les états sont les principaux artisans
de la réalisation de ces droits.
La Convention sur la diversité biologique énonce un certain
nombre de dispositions dont le principe général est posé dans l’article 8 j : « Chaque Partie […] sous réserve des
dispositions de la législation nationale, respecte, préserve et maintient les connaissances,
innovations et pratiques des communautés autochtones et locales qui incarnent
des modes de vie traditionnels présentant un intérêt pour la conservation et
l’utilisation durable de la diversité biologique et en favorise l’application
sur une plus grande échelle, avec l’accord et la participation des dépositaires
de ces connaissances, innovations et pratiques et encourage le partage
équitable des avantages découlant de l’utilisation de ces connaissances,
innovations et pratiques ». [2]
Le principe ainsi posé soulève cependant un certain nombre de difficultés. Tout d’abord se pose le problème de la constatation de ces connaissances qui, le plus souvent, sont uniquement orales et ne reposent que très rarement sur un document écrit. Elles ne résultent également pas nécessairement d’un acte individuel et spécifique de découverte. Les variétés qui font l’objet de ce savoir sont sélectionnées la plupart du temps sur leur capacité à s’adapter à un environnement fluctuant et évidemment pas sur les critères définis dans les pays industrialisés par l’U.P.O.V., à savoir nouveauté, distinction, stabilité et uniformité.
Ces caractéristiques des savoirs traditionnels peuvent être des obstacles considérables. Les connaissances traditionnelles doivent être normalement considérées comme n’importe quelle forme d’antériorité. Cependant elles doivent permettre à une personne qualifiée de créer la nouveauté en question, et il doit être possible de prouver juridiquement cette antériorité. Ces deux conditions doivent être, la plupart du temps, très difficile à remplir.
Un autre problème difficile est de déterminer à qui
appartiennent ces connaissances. Celles-ci peuvent être l’apanage d’une seule
personne ou d’une communauté dans son ensemble. Dans cette dernière situation,
il peut s’agir d’une communauté très étendue qui peut se trouver à cheval sur
deux frontières ou plus, comme cela peut être souvent le cas dans nombre de
pays en voie de développement. Là encore les questions de preuve juridique
peuvent être très difficiles à résoudre. [7]
C. La bio prospection à but pharmaceutique
La bioprospection à but pharmaceutique fait partie de la
stratégie des industriels pour découvrir de nouvelles molécules et élaborer de
nouveaux médicaments. La première voie consiste à la construction de molécules
qui entrent en interaction avec une cible moléculaire identifiée, le plus
souvent une protéine, dont le dysfonctionnement est impliqué dans une maladie.
On recherche ensuite dans les banques de molécules celles qui vont présenter
les meilleures ressemblances avec cette protéine afin de l'améliorer pour la
transformer en médicament actif. [5][32]
La seconde méthode est l'approche aléatoire consistant à
passer au crible d'un test biologique le plus grand nombre possible de
molécules. Ces nouvelles molécules peuvent être fournies par la chimie
combinatoire ou par les substances naturelles. Celles-ci ont déjà fourni un
grand nombre de médicaments : on peut citer à cet égard, entre autres, la
morphine, l'aspirine, la digitaline, la quinine ou, plus près de nous, en
matière de lutte contre les affections cancéreuses, les dérivés de la pervenche
de Madagascar et le taxotère.
Cependant, dans la pratique, le chemin est souvent très long
entre la plante et le médicament. Les premières difficultés consistent à
trouver physiquement les végétaux adéquats. Pour cela il est possible de
recourir au criblage systématique, aux connaissances locales ou à une démarche
chimio-taxonomique, c'est-à-dire à une exploration des espèces d'une même
famille réputée pour ses substances utiles. Il est ensuite nécessaire de
réaliser une extraction et une purification de la matière brute pour recueillir
des composés chimiques les plus purs possibles, puis procéder à des tests pour
déceler une éventuelle activité biologique.[6][5]
A ce stade la sélection est sévère car il est généralement
estimé que seulement une molécule sur 10 000 est validée pour pouvoir
aboutir, notamment après la multitude d'essais nécessaires, à la mise sur le
marché d'un médicament.
Il est certainement indispensable de donner une rémunération
pour la collecte de plantes ou de connaissances qui aboutira à la mise au point
d'un médicament. La forme du paiement est cependant difficile à concevoir. En
effet, une rémunération forfaitaire pourrait être d'abord envisagée, mais qui
sera inévitablement comparée aux revenus pouvant être très élevés de
l'entreprise pharmaceutique. Un intéressement aux bénéfices peut être possible
mais celui-ci ne peut intervenir que dix ou quinze ans, ou plus, après la
récolte de la plante ou la communication des savoirs traditionnels.
La valeur réelle de la biodiversité des pays en
développement est certainement amoindrie par l'existence à travers le monde de
collections comme celles des C.I.R.A. ou de nombreuses institutions
scientifiques qui détiennent d'importantes banques de ressources génétiques,
microbiennes, animales ou humaines. Il peut être aussi noter qu'il n'est pas
toujours nécessaire de se rendre auprès des collectivités traditionnelles pour
acquérir leur savoir, celui-ci se trouvant déjà consigné dans de nombreuses
publications scientifiques.
Enfin il faut tenir compte des possibilités de reproduction
des principes actifs qui peuvent être découverts dans des ressources
naturelles. En effet, grâce aux progrès scientifiques, une analyse chimique ou
génétique n'exige que de très petites quantités de matériel tangible. Cela rend
possible la reproduction du, ou des, principe(s) actif(s) soit par chimie
combinatoire ou de synthèse soit par remodelage biologique d'un autre organisme
par transgenèse. [5][6][1]
C'est pourquoi les modalités de restriction d'accès physique
perdront probablement de leur importance au profit des modalités régissant
l'utilisation et le contrôle de l'information proprement dite. De plus, il est
tout à fait justifié que les pays en développement souhaitent tirer parti des
ressources génétiques présentes sur leur territoire comme le font d’autres pays
de leurs ressources fossiles.
Il ne faut cependant pas qu’ils surestiment les gains qu’ils
pourraient en retirer compte tenu des différentes façons de contourner la
bioprospection in situ, sans parler du « biopiratage » certainement
impossible à éradiquer complètement. Il serait alors primordial pour les pays
en développement de développer une approche en terme de contrôle des
informations intangibles pouvant être recueillies à partir de leurs ressources
génétiques.
Le vrai défi pour les pays est de pouvoir ajouter eux-mêmes
de la valeur à leurs ressources génétiques brutes plutôt que de les exporter
vers d'autres pays où seront développés les produits finis et, en fin de
compte, réalisés les plus importants profits. C'est certainement une voie très
difficile mais elle a commencé à être empruntée par un certain nombre de pays
comme l'Inde ou le Costa Rica à une plus modeste échelle.[5]
Conclusion
Les plantes transgéniques représentent un support important
et nouveau pour la fabrication de molécules d’intérêt pharmaceutiques. En
effet, avec l’amélioration et la diversification des techniques de transgénèses,
les plantes ont pu être converti en plate-forme de production. De plus la
diversité des espèces végétale offre une multitude de possibilités de
valorisation des ressources génétiques. Divers molécules thérapeutiques sont
produis soit par voie direct comme la production d’anticorps et de lipase
gastrique ou par voie indirect comme le ginkgolide. Cependant les
limitations actuelles de production de protéines recombinantes humaines chez
les plantes sont les difficultés de processus d’extraction et surtout
l’apparition de structure de glycanes non authentiques sur les protéines
recombinantes. De plus il faut noter des différences d’activité de la protéine
selon le site d’exportation.
La synthèse de produits biopharmaceutiques est également
possible dans d’autres organismes comme les bactéries, les levures ou les
animaux- et entre en compétition avec la production chez les plantes. Cependant
les plantes restent le système de production le plus avantageux (coût,
quantité, sécurité sanitaire).
La plante transgénique est considérée comme un système de
production de molécules thérapeutiques. Par ailleurs, lorsque cette molécule
thérapeutiques est mis en évidences dans le « patrimoine naturel»
d’une population autochtone comme dans le cas du ginkgo, le problème vis à vis
détenteur légitime de la ressource génétique peut être posé. En effet
l’appareil politique reste flou, ou trop consensuel, pour savoir dans quelles
mesures la population locale ou de l’entreprise qui a réalisé de la
bioprospection a un droit sur la plante et la molécule produite.
L’évolution du droit de propriété intellectuelle a permis l’appropriation du vivant ce qui peut avoir des conséquences importantes sur les populations locales. Le passage de la notion de « patrimoine mondiale de l’humanité » à la « brevetabilité du vivant » pose de réels problèmes et il serait utile de redéfinir les différents niveaux de protection. Dans l’intérêt de l’axe nord-sud il serait essentiel que la recherche publique prenne un poids plus important avec les paniers de brevet par exemple tout en permettant aux communautés locales de tirer profits de leurs savoirs. En ce sens la Convention de la Diversité Biologique ne permet pas une protection concrète de ses populations car la plupart des savoirs sont transmis oralement et ne sont pas écrit.